【推荐阅读】

疫苗事件和医药监管
来源:泽平宏观
文:恒大研究院任泽平 李建国 孔艺颖
实习生颜磊对数据收集有贡献
疫苗,事关国计民生和人民生命健康,却成为部分不法分子牟取暴利的工具。近年我国疫苗事件频发,违法违规乱像触目惊心,甚至重大案件一年数起。是什么造成了这些乱像?
除了将不法企业和个人绳之于法,我们必须重新审视我国医药监管体制和疫苗产业的深层次问题,以此为契机深刻反思并作出重大改革,从根本上治理,避免悲剧一再重演,推动高质量发展和满足人民美好生活需要。虽然有时推动社会进步像化石一样漫长,但我们必须怀抱理想主义,砥砺前行,愿生命得到尊重。


1 我国疫苗产业和监管现状
1.1 我国免疫规划发展
我国在建国以前,免疫预防工作十分落后,天花、白喉、百日咳、麻疹等传染病严重威胁我国人民的身体健康。
建国之后,我国逐渐意识到开展人群免疫工作的必要性。50年代,全国多次开展普种牛痘;60年代,在全国开展卡介苗、脊灰疫苗、麻疹疫苗和百白破疫苗“四苗”的接种工作;70年代初,开始免费接种破伤风类毒素。
1978年以后,我国正式实施计划免疫,卡介苗、脊灰疫苗、百白破疫苗、麻疹疫苗列入国家免疫规划,并经过1992年、2008年、2016年三次增补,将国家免疫规划的疫苗扩充至14种,即我国现有的14苗15病的一类疫苗。
我国一类疫苗是政府免费向公民提供的疫苗,费用由政府承担,垄断程度较高,二类疫苗是公民自费接种的其他疫苗,费用由受种者或其监护人承担,市场竞争激烈。

1.2 我国疫苗产业现状:生产大国,高速增长
总量方面,我国是世界上最大的疫苗生产国,共有45家疫苗生产企业,可生产63种疫苗,预防34种传染病,是世界上为数不多的能够依靠自身能力解决全部计划免疫疫苗的国家之一。2015年我国疫苗产业市场规模从2005年的65亿元增至245亿元,年均复合增长率达14%。
市场结构方面,《2017年生物制品批签发年报》显示,我国每年批签发疫苗约5-10亿人份,其中国产疫苗占据绝大部分份额,进口疫苗仅占5%以下。

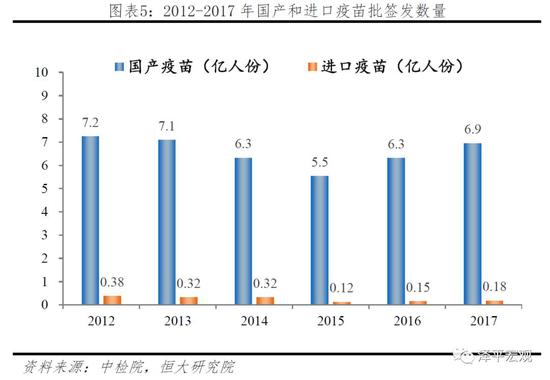
1.3 疫苗上市流程:环节多,周期长
我国疫苗从研发到使用主要可以分为五大阶段:研发阶段、注册阶段、生产阶段、流通阶段、使用阶段。

研发阶段。研发阶段一般8-10年,具体分为实验室研制、临床前研究、临床试验。实验室研制需要经过反复尝试才能得到与预期效果相符的疫苗,实验室研制后要进行临床前研究,这一阶段需要动物实验。所有动物安全性评价的前提下,可以向药品监管部门申请临床试验,临床试验分为I、II、III期三个研究阶段,III期临床试验结束,证实获得预期临床效果,且安全性良好,企业方可进行后续的药品注册证申请工作。
注册阶段。注册阶段一般3-5年,生产企业将研发阶段形成的所有资料递交药品监管部门申报药品注册证。药品监管部门受理申请后,依照法定程序,对拟上市销售疫苗的安全性、有效性、质量可控性等进行审查。经过产品技术文件审查、生产现场核查以及整改后再审查(如需要)等一系列过程,且合格之后,药品生产企业才能拿到药品的注册批件。试生产一月之后,经过CFDA组织相关技术人员根据《药品生产质量管理规范》(GMP)对生产线进行检查合格后,方可取得GMP证书。药品注册批件及GMP证书均取得后,生产企业才正式可以生产用于上市的产品。
生产阶段。企业拿到注册生产批件后,需按照已批准的工艺流程进行采购、生产、检定、灌装等操作。每批疫苗生产出后,需送至我国食品药品检定研究院进行批签发,检验合格后拿到批签发合格证,产品方可上市销售。
流通阶段。这一阶段主要就是销售以及产品运输、储存的过程,要严格按照《疫苗流通和预防接种条例》的要求,在省级公共资源平台获得中标采购合同,方可按照要求配送到疫苗接种单位。
使用阶段。疫苗接种单位根据要求接种疫苗,这一阶段还有一部分临床研究称之为IV期临床研究,是指新药上市后应用研究阶段,以考察疫苗在大面积人群使用的安全性和有效性。
1.4 疫苗管理体系:重审批,轻监管,头重脚轻
整体而言,2011年我国首次通过世卫组织国家疫苗管理体系评估,并于2014年通过该体系复评,我国疫苗管理体系已初步形成。目前我国疫苗监督管理涵盖上市许可、批签发、上市后监管(包括接种后不良反应监测)、实验室管理、监管检查(GMP)和临床试验监管6项职能,覆盖了从疫苗研发到使用的各个环节。
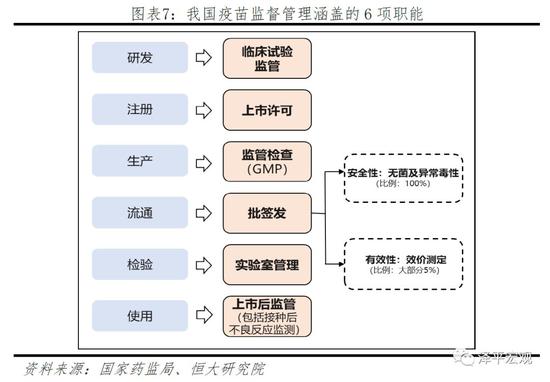
但我国疫苗管理体系仍然存在“头重脚轻”的问题,即重审批、轻监管。疫苗监管包括上市前监管与上市后监管:上市前监管,主要是以注册审评为核心的注册审查体系,包括非临床研究资料、临床研究资料审查,以及生产体系考核,全部通过后方可取得药品注册批件及GMP证书;上市后监管,主要依据《药品生产质量管理规范》、《药品经营质量管理规范》等规章,通过检查、不良事件监测、疫苗召回等方式实现,具体检查措施有抽查、飞行检查、有因检查,抽检由中检院负责实施,飞行检查、有因检查由药品审核查验中心依据生产质量管理规范开展,检查过程中,主要依赖检查员现场核实,逐条检查。
在疫苗管理体系中,批签发是确保疫苗安全有效的最后一道关口。我国从2006年1月1日对全部上市疫苗实施批签发,即每批制品出厂上市或者进口时进行强制性检验、审核的制度。检验不合格或者审核不被批准,不得上市或者进口。批签发之前,中检院对疫苗的安全性、有效性进行检验,对于安全性是全部批次都检验,而对于有效性则进行随机抽样检验,不同品种抽验比例不同,大部分比例为5%。
根据中检院《2017年国家药品抽检年报》,2017年国家药品抽检共抽检生物制品91批次,涉及预防类4个品种、治疗类2个品种、诊断类1个品种。经检验,符合规定89批次,不符合规定2批次,均为吸附无细胞百白破联合疫苗。吸附无细胞百白破联合疫苗共抽取两个厂家4批次产品,所有批次检品的鉴别试验、安全性检测项目均符合规定,但有2批次疫苗效价测定不符合规定,其中1批次破伤风效价和百日咳效价不符合规定,1批次百日咳效价不符合规定。
2 我国疫苗产业和监管的主要问题
2.1 近年来疫苗安全事故频发
近年来,我国疫苗安全事故频发,平均隔年一起,甚至每年一起、一年数起。在各类疫苗安全事故中,狂犬疫苗成为重灾区,原因是狂犬疫苗在二类疫苗中销售额最高,最为有利可图(参考图表1)。
2.2 行业生态:以渠道营销、追逐利润为核心,缺少安全和法律意识
我国疫苗行业起步较晚,目前整体尚处于早期发展阶段,渠道营销、追逐利润仍是行业发展的本质,销售费用高企、商业贿赂事件频发,尊重生命、重视质量的行业氛围有待提高,良性的行业生态尚未有效建立。
A股医疗保健板块共有290家公司,其中4家以疫苗为主业。Wind数据显示,2017年A股医疗保健板块总销售费用达1772亿元,占总营业收入的15%,其中14家超过50%;4家疫苗公司总销售费用达18亿元,占营业收入38%;4家国际疫苗巨头(辉瑞、默沙东、赛诺菲、GSK)总销售费用占比28%。反观研发费用,A股医疗保健板块总研发费用319亿元,占总营业收入的2.8%;4家疫苗公司除沃森生物外,研发费用占比均未超过10%;4家国际疫苗巨头总研发费用占比17%。


近5年涉人用疫苗犯罪刑事案件共408件,其中行贿、受贿、对单位行贿共166件,占比44%。

2.3 药监系统:有效性检验不足、处罚不力
资源限制导致质检重安全性、轻有效性。在国家疫苗管理体系中,批签发是疫苗上市使用前确保安全有效的最后一道关口,但目前中检院由于资源限制,只对疫苗安全性进行批批检验,有效性检验比例大部分仅为5%,而此次长生生物事件中的百白破疫苗正是有效性上出了问题。
我国药品管理法及地方药监的行政隶属关系导致处罚不力。我国药品管理法对生产销售假药及劣药的处罚做出了规定,罚款金额仅为货值金额的2-5倍及1-3倍,震慑力有限。另一方面我国地方食药监局在行政费用、人事任命等方面均由地方政府负责和管理,国家药监局只有业务指导权,也是地方食药监局对违规行为处罚不力的原因。

2.4 生产企业:质控部门不独立
全球来看,企业内部的质控体系是保障疫苗制品安全有效的主要环节之一。辉瑞、默沙东等大型跨国药企是疫苗行业质量控制的标杆,质控体系完善,质控部门地位较高且相对独立,对疫苗制品的出厂与否具有一票否决权,保障了出厂疫苗制品的安全有效。
而我国疫苗制品质量的保障主要以政府监管为主,生产企业普遍缺乏完善的质控体系,质控部门在企业内部地位不高,对疫苗制品的出厂销售无决定权,在国内渠道营销、追逐利润的行业生态下,企业质控部门难以充分发挥作用,成为我国疫苗行业安全事故频发的重要原因。

3 国际经验
3.1 美国
美国于1980年代先后通过了《国家儿童疫苗伤害法案》和《疫苗伤害赔偿程序》,并由此建立了疫苗安全管理体系的基本框架:国家疫苗项目办公室(NVPO)、疫苗信息陈述书(VIS)、疫苗不良反应监测系统(VAERS)、国家疫苗伤残补偿项目。在严格的监管体系下,美国FDA过去10年只强制召回疫苗3次,一次是标签错误,一次是生产过程污染,一次是生产过程可能存在的制造问题。

3.1.1 1955年脊灰疫苗事件
1955年,美国卡特实验室制造的脊灰疫苗因病毒灭活不充分,部分疫苗含有活体病毒,而安全检测也未发现,最终造成4万人染病、113人终生瘫痪、5名儿童死亡。事件发生后,生产方向受害者及家庭支付了数百万美元的巨额赔偿,同时卡特实验室微生物研究所所长被开除,美国卫生部秘书长Hobby和美国国立卫生研究院主任Sebrell引咎辞职。
这一事件及1970年代的百白破疫苗安全问题共同导致了美国的疫苗抵制运动,疫苗接种率直线下降,导致美国脊髓灰质炎发病率出现反复。为了重建民众对疫苗的信心,美国国会于1986年、1988年分别通过了《国家儿童疫苗伤害法案》、《疫苗伤害赔偿程序》,逐步建立了美国疫苗安全管理体系的基本框架:国家疫苗项目办公室(NVPO)、疫苗信息陈述书(VIS)、疫苗不良反应监测系统(VAERS)、疫苗救济基金。
3.1.2 国家疫苗项目办公室(NVPO)
国家疫苗项目办公室负责协调所有和疫苗相关的政府部门活动,包括CDC(疾控中心)、FDA(食药监局)和HRSA(健康资源和服务管理局)。其中FDA的生物制品审评与研究中心职员数量超过1000人,随时监控上市后疫苗的安全风险,发现问题后可立即责成疫苗召回或下架。
3.1.3 疫苗信息陈述书(VIS)
疫苗信息陈述书由美国CDC制作并下发给各州及地方的卫生机构、医院,并要求在接种前必须向被接种者或监护人提供。疫苗信息陈述书内容包括疫苗所预防疾病的简单描述、益处及风险。
3.1.4 疫苗不良反应监测系统(VAERS)
美国疫苗不良反应监测系统于1990年建立,用于收集和分析接种疫苗后产生的所有健康影响,包括与疫苗本身无关的影响。该系统最大特点为无门槛,任何人均可向该系统提交报告。2017年共提交不良反应报告约3.9万份,其中严重不良反应6400个。
3.1.5 国家疫苗伤残补偿项目
国家疫苗伤残补偿项目,即疫苗救济基金,用于赔偿由于接种疫苗而产生的个人健康伤害。资金来源于疫苗伤害表中疫苗的税收收入,征收标准为1个接种剂量缴纳0.75美元税收。赔偿方案基于“无过错”原则,即不需要证明医疗机构或疫苗生产商存在过错。1988年以来,该基金共收到约1.8万份赔偿申请,其中90%得到裁定,30%得到赔偿,赔偿总额37亿美元。
3.2 日本
日本疫苗管理制度在经历多次安全事故后不断强化,目前疫苗管理制度在国际上较为先进,尤其是电子信息化水平、不良反应的全部上报原则、赔偿的结果责任原则具有鲜明的特点,保证了日本疫苗管理的全程可追溯、标准化及风险控制水平。
3.2.1 1996年乙肝疫苗事件
1996年起,日本脏器制药公司生产的乙肝疫苗使用了艾滋病及乙肝携带者的血清,导致部分接种者患病。该事件最终迫使日本厚生省向受害者进行了总额3.2万亿日元(390亿美元)的赔偿,成为日本历史上最大的国家赔偿案件。
3.2.2 全程可追溯:条形码、电子标签
日本疫苗制品生产、流通等各环节管理严格,充分利用条形码、电子标签等技术手段,每支疫苗均记录有从出厂到使用的各类信息,最大程度保障疫苗的安全有效,同时提高整个行业的标准化及规范化水平。
3.2.3 接种:充分信息说明
接种前,医生会首先检查接种者身体并告知疫苗的批次、可能的不良反应及护理措施等信息,接种后需等待15分钟,护士确认没有过敏及异常反应后方可离开。
3.2.4 不良反应:全部上报
日本规定,生产厂家需将所生产疫苗的所有不良反应上报,同时在不良反应监测机构中增加第三方医师及专家,以增强社会监督。而国际通行做法为“安全比率”,即不良反应在一定比率下不予上报,日本做法明显严于国际通行做法。
3.2.5 赔偿:结果责任原则
1994年和1999年,日本两次修改《预防接种法》中国家责任部分,规定对疫苗接种事故实行结果责任原则,即无论过失如何,只要厚生劳动大臣认定不良反应由疫苗接种导致,接种者即可获得补偿,包括医药费、住院津贴、残疾儿童养育补助、一次性死亡补助、丧葬费等。
4 建议
4.1 增强药监系统独立性
在行政费用及人事任命上增强药监系统的独立性,提高国家药监局对地方药监局的实际管辖权,或将医药安全情况记入当地政府的政绩考核。
4.2 适当提高批签发有效性检验比例
将目前大部分品种5%的有效性抽检比例提高至10%或更高,提高对疫苗有效性的检验力度,增强对“无效无害”疫苗的监管和打压力度。
4.3 检验机构市场化
借鉴发达国家的模式,放开检验机构的行业限制,将检验机构进行市场化改革,在有效监管下提高运行效率。
4.4 提高假劣药罚款金额上限,加强震慑力
将目前假劣药罚款金额上限由货值的5倍、3倍提高至10倍、5倍或更高,增强法律对生产销售假劣疫苗的震慑力,并对主要涉案人员实行终身市场禁入处罚。
4.5 建立疫苗事故赔偿制度
建立政府主导的疫苗救济基金,出台具体赔偿流程方案,消除公众对疫苗的疑虑,避免疫苗抵制及流行病反弹。
4.6 引导疫苗生产企业建立现代企业管理制度,提高质量控制水平
提高企业的质量控制水平是疫苗制品安全有效的重要保障,因此应积极借鉴跨国制药公司的质控体系,提高质控部门的地位及独立性,从源头减少问题疫苗的产生。
4.7 加强信息公开及科普,避免疫苗抵制
根据WHO估计,免疫接种目前每年可预防200万-300万例死亡,免疫是最成功和最具成本效益的公共卫生干预措施之一。面对负向事件和舆论,卫生服务机构应发挥职能,加强对免疫工作的科普工作。人民群众需正确认识免疫的重要性,切忌谈苗色变、抵制疫苗。
责任编辑:李彦丽
热门推荐
收起
24小时滚动播报最新的财经资讯和视频,更多粉丝福利扫描二维码关注(sinafinance)








