多款重磅新药研发取得关键进展,中国新药进军全球市场 | 红杉医疗头条
前沿&动态
英诺特新冠抗原检测试剂在沙特获批,为世界新冠防疫贡献新力量
伴随奥密克戎、德尔塔等变种新冠病毒的继续传播,新冠疫情仍在全球范围内肆掠。作为新冠重要防控手段的新冠检测及对应产品线,将持续、长久的发挥重要作用。近日,英诺特宣布其新冠抗原检测试剂(乳胶层析法)获得沙特阿拉伯医疗器械市场准入证书。这也意味着英诺特将助力该国对新冠疫情的防控,为世界新冠防疫贡献新力量。
英诺特是中国最早从事新冠检测产品研发、生产、销售的企业之一,也是在2020年最早获得国家新冠抗体检测产品注册证的企业之一,公司拥有新冠抗原检测、抗体检测、核酸检测等新冠检测全系列的产品,并获得世界上多个国家的准入认证,产品出口全世界60多个国家和地区,积累了成熟的新冠产品研发体系和销售渠道体系。截至目前,英诺特新冠抗原检测试剂方已经取得欧盟CE认证,同时获得了德国、法国、荷兰、巴西、阿根廷、菲律宾、泰国等全世界众多国家的市场准入资格。
助力疫情防控,博瑞医药等5家中国药企获得默沙东口服新冠药免费仿制授权
近日,日内瓦药品专利池(MPP)宣布,已与27家仿制药公司签署协议生产默沙东口服新冠药 Molnupiravir,其中有包括博瑞医药在内的5家中国制药企业。这意味着该款新冠药物将得到更好的产能,同时也意味着博瑞医药的研发能力、生产能力以及规范化运营能力都获得了来自全球顶级药企的认可。
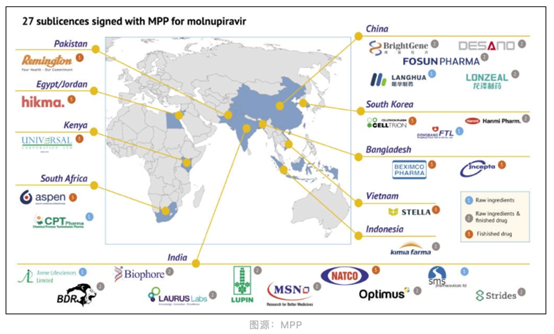
Molnupiravir 是全球首个上市的新冠口服抗病毒药物,由默沙东与 Ridgeback Biotherapeutics 联合开发,用于治疗轻度到中度新冠肺炎患者。2021年10月,默沙东与药品专利池(MPP)签署协议,对 105 个中低收入国家放弃他们刚刚获批的口服新冠药物 molnupiravir 专利。
迪哲医药DZD9008再获突破性疗法认定,新药研发加速进行
近日,迪哲医药宣布其用于治疗EGFR 20号外显子插入突变非小细胞肺癌患者的在研产品DZD9008,获得美国食品药品监督管理局(FDA)突破性疗法认定(Breakthrough Therapy Designation)。这是继2020年12月DZD9008获得中国国家药品监督管理局药品审评中心 “突破性治疗药物品种”认定资格后又一重要里程碑。中美两国突破性疗法双重认定彰显了迪哲医药在非小细胞肺癌EGFR小分子靶向创新药领域的研发实力。
DZD9008是迪哲医药自主研发的针对EGFR/HER2 20号外显子插入突变设计的全球首创小分子化合物,首选适应症为治疗EGFR 20号外显子插入突变非小细胞肺癌,目前处于国际多中心II期单臂关键性临床试验阶段,正在中国、美国、韩国、澳大利亚、日本、法国等国家和地区开展临床试验。根据相关规定,研发中的新药一旦被授予突破性疗法认定,便能享受一系列加速药物开发的政策,包括FDA专家介入指导临床开发整个过程,有效提升与FDA的沟通效率。
国内首个先天性黑蒙基因治疗新药临床试验申请获CDE受理,朗信生物AAV基因疗法迈出关键一步
据国家药品监督管理局药品审评中心(CDE)官网信息,由上海朗信启昇(朗昇生物)生物制药有限公司自主研发的AAV2-PRE65基因治疗制剂LX101眼用注射液的临床试验申请,已获得受理(受理号:CXSL2200048)。
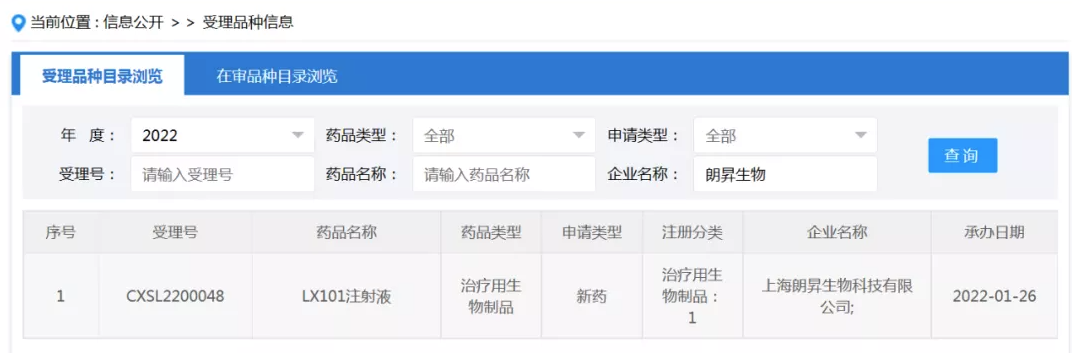
LX101眼用注射液是目前国内递交的首个先天性黑蒙基因治疗新药临床试验申请。先天性黑蒙LCA是一类发生最早、最严重的遗传性视网膜病变, 大多数LCA患者在婴儿期或儿童期开始出现严重视力障碍,并且由于进行性视网膜变性,在30-40岁时彻底失明。LCA目前尚无有效方法治疗,直到近些年来基因治疗领域的快速发展,这种严重视网膜遗传病才有了可用的治疗方法。
2021年6月,上海朗信生物启动了研究者发起的中国首项针对LCA的基因治疗临床研究,评估单次视网膜下腔注射LX101眼用注射液治疗特定类型先天性黑蒙的总体安全性和疗效。6月24日在上海市第一人民医院眼科中心成功完成首例患者治疗。
天演药业原创抗CD137与抗CTLA-4联合疗法完成全球首例患者给药
近日,天演药业宣布,针对晚期转移性实体肿瘤患者的抗CD137激动型抗体ADG106与抗CTLA-4单克隆抗体(mAb)ADG116的联合疗法临床试验项目,目前已完成首例患者给药,将评估晚期转移型实体肿瘤患者在这一独特原创联合疗法中的安全性和耐受性。
作为单一药物,ADG106与ADG116均显现出了良好的安全性与早期疗效信号。ADG106在中美98位患者的单药临床试验中,患者在3mg/Kg与5mg/Kg剂量组以及300mg与400mg固定剂量下,表现出了良好的耐受性。在ADG116单一疗法评估中,患者在爬坡至10mg/Kg剂量下表现出良好的耐受性,同时观察到了早期疗效信号。
“通过ADG106与ADG116这两款变革性抗体药物的联用,我们希望最大程度发挥同时针对这两条通路的治疗潜力,安全有效地抑制肿瘤生长。”加拿大皇家内科学会会员、美国内科医师学会会员、NEXT Oncology™联合创始人与研究员Anthony W. Tolcher医学博士表示。天演药业联合创始人、首席执行官兼董事长罗培志博士亦表示,“我们很自豪能够开创并探索这一创新的临床联合疗法,这也展现了天演的新表位抗体NEObody™平台的高转化率。”
国内首个IDH1抑制剂获批,基石药业为急性髓系白血病患者提供新治疗选择
2月9日,基石药业宣布中国国家药品监督管理局(NMPA)已批准同类首创药物拓舒沃®(艾伏尼布片)的新药上市申请,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病(R/R AML),为该患者人群提供了新的精准治疗选择。
急性髓系白血病(AML)是成人白血病中最常见的类型,疾病进展迅速,绝大多数为老年患者。在美国,每年约有2万新发病例,患者五年生存率约29%。伴随着人口老龄化,中国AML发病率呈逐年上升趋势,其中尤以老年和复发或难治性患者预后较差。在中国,每年约有7.53万白血病新发病例,其中AML患者的占比约为59%,而在这些患者中约6~10%携带IDH1突变。
从新药上市申请获得受理到成功获批仅用了6个月的时间,这再一次体现了基石速度。“作为国内首个获批的IDH1抑制剂,我们欣喜地看到拓舒沃®在针对IDH1突变的AML患者中展现了良好的疗效与安全性。”拓舒沃®中国注册桥接研究CS3010-101主要研究者、中国医学科学院血液病医院王建祥教授表示。
趋势&焦点
推进细胞疗法开发,博雅辑因接连宣布两起重要合作
2月8日,博雅辑因宣布与Arbor Biotechnologies达成全球非独占许可协议,以利用Arbor拥有自主知识产权的CRISPR基因编辑技术开发针对肿瘤的特定体外细胞疗法。9日,博雅辑因与星奕昂生物共同宣布,双方将基于博雅辑因在高通量基因组编辑筛选方面以及星奕昂生物在诱导性多能干细胞(iPSC)和自然杀伤细胞(NK Cell)细胞功能和生产工艺方面的技术和资源优势,研发合作新一代免疫细胞疗法。


根据公司与双方的合作内容,博雅辑因将通过合作进一步拓展公司的基因编辑工具箱,增强科研及转化能力,并推进公司正在开展的、针对多种严重疾病的体外基因编辑细胞疗法项目。同时亦可发挥公司在基因编辑技术应用与转化方面的经验,加速iPSC-NK领域的创新免疫细胞疗法研发,尽早为患者带来更多治疗选择。
易瑞生物多款快速检测产品入围公安部警用装备协议采购目录
据易瑞生物微信公众号,近日公安部警用装备采购中心向公司下发《入围通知书》,确认其多款产品入围,入选公安部警用通信设备、安全检查监视报警设备、出入境设备、网络监察设备、警用取证、物证鉴定设备等协议供货目录。具体来说,包括EASY-05唾液毒品检测仪、EASY-11毛发毒品检测仪、YR-660食品安全快速检测仪、YR-820恒温扩增荧光检测仪等四款产品。
易瑞生物表示,此次四款产品入围警用装备项目,除了产品本身技术、工艺等优于行业水平外,也体现了易瑞生物的研发实力、产品质量获得认可。
经过十余年的深入研究与系统性的投资布局,红杉中国在医疗健康领域先后投资了超过200家具有鲜明技术特征和高成长性的医疗健康企业,投资范围覆盖创新药、医疗器械、医疗服务、精准医疗、数字医疗等多个细分领域,其中超过40家已经在A股、港股、美股完成IPO。
“红杉医疗头条”每两周定期发布,聚焦红杉医疗成员企业的最新动态,分享行业的最新洞见。


(声明:本文仅代表作者观点,不代表新浪网立场。)





