(来源:市场投研资讯)
贝福替尼和 KRAS G12C 抑制剂已获批,有望进入商业化放量阶段
贝福替尼关于NSCLC的一、二线治疗均已纳入医保目录。三代EGFR TKI 贝福替尼的商业化权益授予贝达药业,二线治疗适应症已经纳入2023年医保目录;一线NSCLC适应症通过今年的医保谈判,成功纳入2024年医保目录,2025年有望取得较好的销售增长。
公司自主研发的 KRAS G12C 抑制剂格索雷塞(D-1553)的 NSCLC 适应症获批上市。在中国,约 2.9-4.3%的 NSCLC 患者携带KRAS G12C 突变,这部分患者人群疾病进展迅速且预后较差,在现有非靶向治疗方案中的获益有限,存在未满足的临床需求。目前在中国内地,针对 KRAS G12C 突变的 NSCLC 患者的二线治疗药物仅有同靶点的信达生物的氟泽雷塞片获批上市,无进口同靶点药物先上市占据国内市场,竞争格局好,销售前景值得期待。
TYK2 抑制剂数据优异,并有口服SERD等在研品种,具有想象空间
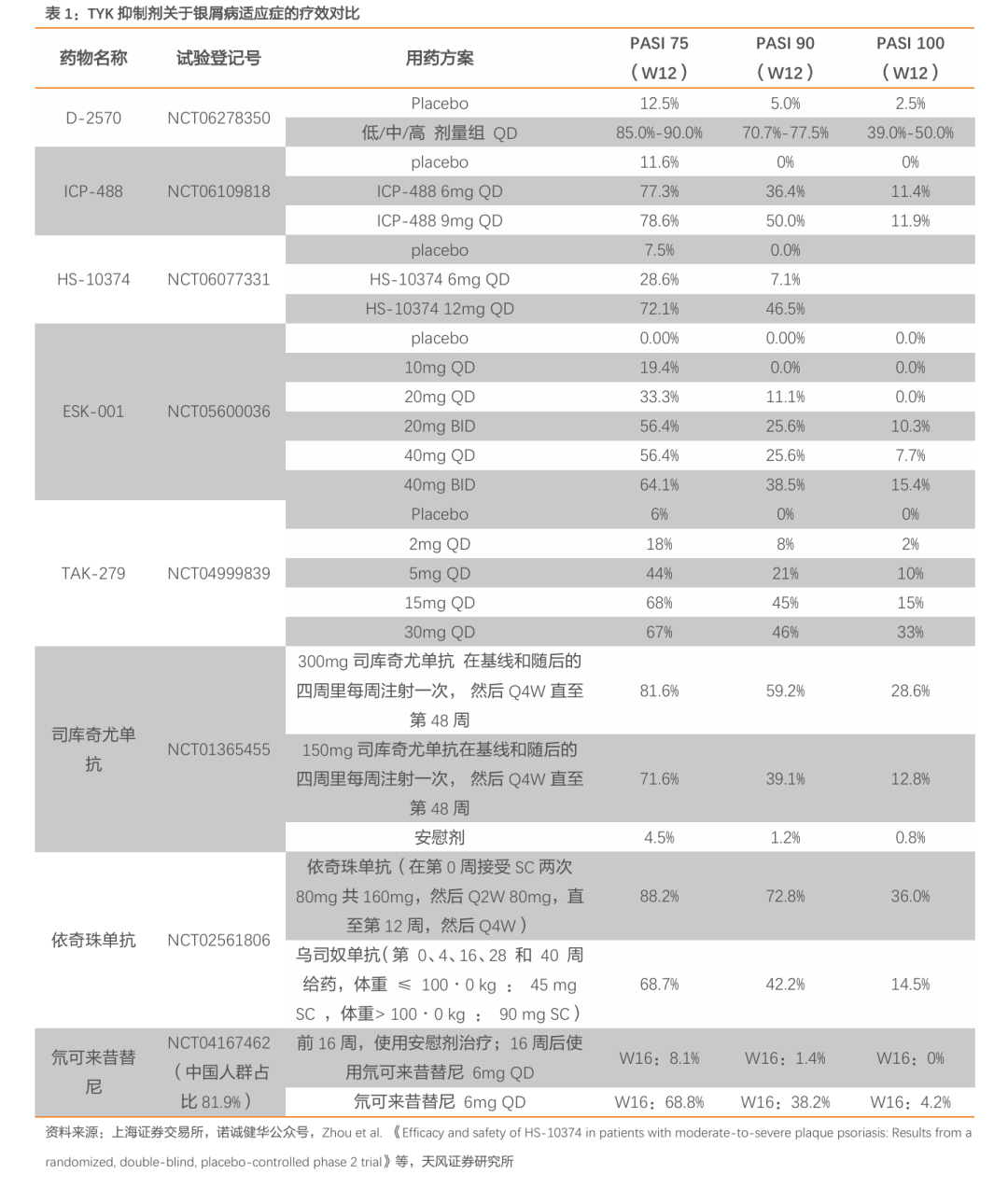
公司D-2570(TYK2)银屑病的II期临床试验数据优异。D-2570的数据表现也优于已上市的同类TYK2抑制剂,并且在效果上可与抗体生物药(如抗IL-17A, 抗IL-23抗体)相媲美(非头对头)。在D-2570治疗12周时,低、中、高三个剂量组中PASI 75应答率为85.0%-90.0%,显著高于安慰剂组的12.5%,达到本次研究的主要终点。在其他疗效指标上,三个剂量组PASI 90应答率为70.7%-77.5%,安慰剂组为5.0%。PASI 100应答率为39.0%-50.0%,安慰剂组为2.5%。sPGA 0/1应答率为80.5%-87.5%,安慰剂组为20.0%。
内分泌治疗所对应的HR+/HER2-患者为乳腺癌患者中最常见的分子亚型,根据中国国家癌症中心2024年最新发布的全国癌症报告显示,乳腺癌为女性发病率第二的大癌种,(粗)发病率为51.17/十万人,预计每年新发患者35.7万人,HR+/HER2-患者占比70%,患者基数大。D-0502 是公司自主研发的一款口服选择性雌激素受体降解剂(SERD),用于治疗雌激素受体(ER)阳性、人表皮生长因子受体2(HER2)阴性的乳腺癌,目前单药在国内正在进行III期注册临床试验,进度在国内产品中居第一梯队。
D-0120是公司自主研发的一款URAT1抑制剂,用于治疗高尿酸血症及痛风。该药物在中国已顺利完成临床IIa期试验,目前中美临床试验正在按计划推进中。IIa期试验结果显示,D-0120疗效显著,血尿酸降低达标率高达80%,展现出优良的降尿酸效果。
正文
1. 管线梯队合理,具有持续兑现能力
公司研发管线产品丰富多样,具备自研优势,展现竞争潜力。公司产品主要聚焦于肿瘤、代谢性疾病等重大疾病领域,均为自主研发。截至2024年12月,公司管线产品贝福替尼和D-1553已经获批上市,D-0502、D-0120、D-2570处于临床试验阶段的产品,临床开发的产品项目跨越I期到新药上市申请(NDA)等多个阶段。公司依托独立的自主研发体系持续开发包括针对激酶、肿瘤驱动基因、肿瘤免疫、合成致死通路等一系列临床候选化合物,临床前研究管线布局丰富。
贝福替尼是公司自主研发的三代EGFR TKI,用于治疗EGFR突变阳性的NSCLC。2023年,贝福替尼二线治疗适应症和一线治疗适应症均已获批上市,目前均已进入《国家医保目录》。格索雷塞(D-1553)是公司自主研发的一款KRAS G12C抑制剂,是国内首个自主研发并进入临床试验阶段的KRAS G12C抑制剂,并在美国、澳大利亚等多个国家及地区开展了国际多中心临床试验。2024年11月,格索雷塞在中国内地获批上市,用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期NSCLC成人患者。
D-0502 是公司自主研发用于HR+/HER2- BC适应症的SERD,在中国和美国同步开展了国际多中心的 Ib 期临床试验。目前单药已经在中国内地进入注册性三期临床试验。D-0120是公司研发的URAT1抑制剂,用于治疗高尿酸血症及痛风。在中国已完成国内临床 IIa 期试验,结果显示其疗效显著,血尿酸降低达标率高达80%,显示出了D-0120 优良的降尿酸效果。D-2570是公司自主研发的一款靶向TYK2的新型口服选择性抑制剂,用于治疗银屑病等自身免疫性疾病。2023年6月,D-2570在健康受试者中的I期临床完成入组并完成所有访视。2024年11月,D-2570针对银屑病的II期临床试验已完成,早期临床数据显示了D-2570良好的皮损清除潜力。

2. TYK2 抑制剂II期临床试验数据优秀
TYK2 靶点药物具有口服便利性,并且是JAK家族首个无黑框警告的药物,在慢病管理上具有优势。TYK2药物可以持久显著改善头皮、掌跖皮损,相较生物制剂有一定疗效优势。生物制剂容易出现抵抗,2022年发表于中华皮肤科杂志的文章显示,73例中国患者治疗24周后,49.3%仍残留头皮皮损。
公司D-2570(TYK2)银屑病的II期临床试验数据优异。D-2570的数据表现也优于已上市的同类TYK2抑制剂,并且在效果上可与抗体生物药(如抗IL-17A, 抗IL-23抗体)相媲美(非头对头)。在 D-2570 治疗 12 周时,低、中、高三个剂量组中 PASI 75 应答率为85.0%-90.0%,显著高于安慰剂组的12.5%,达到本次研究的主要终点。在其他疗效指标上,三个剂量组PASI 90应答率为70.7%-77.5%,安慰剂组为5.0%。PASI 100应答率为39.0%-50.0%,安慰剂组为2.5%。sPGA 0/1应答率为80.5%-87.5%,安慰剂组为20.0%。

VIP课程推荐
APP专享直播
热门推荐
收起
24小时滚动播报最新的财经资讯和视频,更多粉丝福利扫描二维码关注(sinafinance)







