药企不懂国际游戏规则 中国药品难进美国国门 | ||||||||
|---|---|---|---|---|---|---|---|---|
| http://finance.sina.com.cn 2005年05月24日 17:47 法制晚报 | ||||||||
|
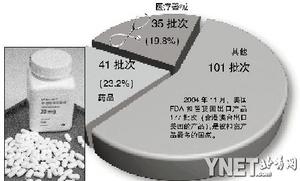 中国医保商会法律部官员称 我国医药企业急需提高出口标准 做好相关注册 每个出口环节做足做细 医药保健品进出口商会连续发布数据 中国药品及医疗器械去年在美被扣达到第一位 多涉及中小企业———
中国医药保健品进出口商会(下称医保商会)近日连续发布数据显示,我国出口到美国的货物,由于不符合其标准和规定经常被美国食品药品监督管理局(FDA)扣押,甚至达到了FDA扣留国家数量的第一位。 据业内人士分析,这种情况并没有好转,对药品和医疗器械扣押的数量仍有所上升。 美国食品药品监督管理局药品登记及国际客户服务中心的工作人员对本报记者说,药品在美国出售必须提前在FDA注册登记,FDA从没有委托任何第三方办法所谓的FDA证书。 中国医保商会 药品被扣多因为不符合销售规定 中国医保商会法律部主任官宁云向本报记者介绍说,去年11月,美国FDA共扣留国外产品1488批次,其中扣留我国出口产品177批次(含港澳台出口美国的产品),是被扣留产品最多的国家。去年10月,美国FDA共扣留我国出口的药品18批次,医疗器械31批次。 其中药品被扣留的主要原因是不符合销售的规定,含有不安全物质,不符合包装、标签和说明的规定,未经批准;医疗器械被扣留的主要原因是不符合销售规定和与有关标准不符。 被FDA扣留的货物中有些易坏的将被直接销毁,有些将被退回到企业手中。但遗憾的是,由于被扣留的货物大多来自中小企业,且许多产品的出口都是企业的自主行为,因此,医保商会虽然每个月都能收到FDA对扣押货物情况的反馈,但却无法统计出到底是哪些企业受此“遭遇”。 FDA药品登记中心 被扣产品的增多与贸易增加有关 记者今晨联系到FDA药品登记及国际客户服务中心,据其工作人员透露,中国的产品在美国被扣押的增多与中美间贸易的增加有关。他还表示,中国的一些医药企业甚至不清楚FDA对外国公司和药品及医疗器械进口的相关规定,一些企业没有甚至不在FDA注册,其生产的产品也不符合美国相关标注,肯定要被扣押。 而据FDA官员透露,FDA机构从未委托任何第三方颁发所谓的FDA证书。目前,还没有一种中草药得到过FDA认证。医保商会法律部官主任也表示,中药在美国只被看作食品增补剂产品,一些中草药的出口也是通过保健品的渠道进入美国,因为保健食品出口美国不需FDA认证,但是如果标签上标明能够治愈某种疾病,则被视作不符合美国标签标准而被扣押。 FDA在美国依照《联邦食品、药品和化妆品法案》和其他一些法律来保护消费者的健康、安全和钱袋。除由美国农业部负责监管的肉和家禽类产品的进口外,FDA对进入美国的食品、药品、生物制剂、化妆品、医疗器械和有放射性的电子产品依法都具有进行检测的职能。 中国医保商会法律部 我国企业出口标准急需提高 医保商会法律部官宁云主任在接受本报记者采访时说,药品和医疗器械关系到人的生命安全,当然应该执行严格的标准。中国的产品要想到美国去销售,就必须遵守美国的相关规定,不符合人家的规定,肯定是被严格禁止销售的。美国食品药品监督管理局是全球监管最严的机构,自身体系非常完善。我国的一些企业不知道具体要求就出口,被扣押就在所难免,也有一部分企业和美国的代理商勾结起来,企图蒙混过关,但往往到了美国那边发现行不通。 官宁云表示,国外针对食品、医药类产品的要求非常严格,我国企业的出口标准急需提高,企业进入美国市场,首先要做好相关注册,考虑到产品销售的各个环节,在每个环节都应该做足做细。他还说,还要重视海关给出的扣留原因说明,并认真做出整改,避免此类事件再次发生。 北京同仁堂公司 企业急需补充国际规则知识 记者致电北京同仁堂公司制药厂,据出口部的工作人员介绍,同仁堂每年都有药品和医疗器械出口美国,但是数量很少。至于出口美国需要办理什么手续或通过什么认证则并不知情,一切事物交给美国的代理商负责。 当记者想进一步采访时,他给了记者专门负责公司药品出口的同仁堂国际有限公司的电话,接电话的负责美国出口的小姐对记者的问题则显得一头雾水,只告诉记者应当遵守人家的规定,至于什么规定则毫不知情。本版撰文/实习生杨全录 FDA药品进口检验程序 药品生产企业的出口产品在药品评价和研究中心登记商标号和药品成分 符合人体临床试验(IND) 符合新药许可上市(NDA)的相关规定 组织专家对药品成分进行鉴定 检查是否含有禁止物质 检查是否符合美国医药业相关标准 检查包装、标签和说明是否存在夸大和误导的行为 FDA医疗器械检验程序 医疗器械执行更加严格的政策,外国公司首先要进行注册 分别列出它们的设备 公司注册时需提交代号为FDA-2891的表格 出口设备则填代号为FDA-2892(设备列表清单)的设备列表单 外国公司委托美国的代理商代为上交 医疗器械严格限制在美销售的情况 1.外国公司如果首次进入美国市场并准备 出口医疗用品则需接受严格审查。 2.无论是外国公司还是国内销售商改变医疗器械原本设计的用途,而这种类型的器械在美国市场是公开合法销售的。 3.对于市场上正在销售的仪器,改变或修改部分部位,而可能导致其安全性或有效性受到影响的。 医疗器械上市前分类管理 据了解,FDA根据管理程度把医 疗器械分为三类进行上市前管理: 一类为“普通管理”产品,是指危险小或无危险性的产品,例如,手术器械、温度计等。符合质量管理体系,即可上市。 二类为“执行标准管理”产品,是指具有一定危害性的产品,例如,心电图仪,超声诊断仪,呼吸机等,要通过实施标准管理的检测,通过510K(上市前通知书)审查后,才能上市出售。 三类为“上市前批准管理”产品,是指具有很大危险性和危害性的产品,或是支持和维持生命的产品,例如人工心脏瓣膜、心脏起搏器等。这类产品实行上市前批准制度(PMA),FDA在收到PMA申请45天内通知厂家立案、审查,FDA可能严格复查有关临床研究,并对工厂进行GMP检查。 FDA行政处罚手段 发警告信 扣押产品 对违法公司提出诉讼 回收产品 2004年11月,美国FDA扣留我国出口产品177批次(含港澳台出口美国的产品),是被扣留产品最多的国家。 典型案例 广东“潘高寿” 办一个FDA认证一般情况至少需要1万美元。据媒体报道,广东“潘高寿”被认为是“第一个被允许在美国各药房公开出售的非处方中成药,实现了中国中草药光明正大走向美国市场零的突破”。当时潘高寿企业委托美国大荣行集团北京办事处办理FDA认证,美国代理商所做的也只是“在说明书及外包装上下些工夫,让产品看起来更符合美国的标准”。在经历了很长时间之后,最终潘高寿企业并没有拿到FDA的认证,而只是一个实验室的证明,表明潘高寿的药品符合了FDA所规定的药品成分要求。 |
| 新浪首页 > 财经纵横 > 产经观察 > 正文 |
|
| ||||
| 热 点 专 题 | ||||
| ||||
| 企 业 服 务 |
| 股票:今日黑马 |
| 怎样迅速挖掘网络财富 |
| 短线最大黑马股票预报 |
| 海顺咨询 安全获利 |
| 开风情布艺店生意火爆 |
| 首家名牌时装折扣店 |
| 如何加盟创业赚大钱? |
| 05年具有潜力好项目 |
| 开麦当劳式美式快餐店 |
| 开冰淇淋店赚得疯狂 |
| 美味--抵挡不住的诱惑 |
| 新行业 新技术 狂赚! |
| 投资3万年利高的惊人 |
| 05年怎样赚大钱? |
| 05年投资赚钱好项目! |
|
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
新浪网财经纵横网友意见留言板 电话:010-82628888-5174 欢迎批评指正 新浪简介 | About Sina | 广告服务 | 联系我们 | 招聘信息 | 网站律师 | SINA English | 会员注册 | 产品答疑 Copyright © 1996 - 2005 SINA Inc. All Rights Reserved
|







